Из книги М. Одена "Роды и эволюция Homo sapiens" –
И сотворили микробы человека
Этот заголовок на первой странице журнала «Экономист», вышедшего летом 2012 года, – типичный пример того, как вдруг осеняет журналистов: они осознали, насколько важную роль сыграла так называемая микробиомная революция. Вот еще один пример заголовка: «Микробы – это и есть мы» ‒ так назвали статью в «Нью-Йоркере».
Опираясь на сегодняшние научные представления, мы рассмотрели организм человека разумного как экосистему, в которой постоянно взаимодействуют триллионы клеток: производное наших генов («хозяин») ‒ и сотни триллионов микроорганизмов, заселивших его («микробиом»).
Мы на удивление долго не понимали, что интересы хозяина и микробиома согласуются. Хозяин дает сырье и жилье, а сотни триллионов микроорганизмов кормят и защищают своего хозяина. Видимо, в нашей культуре со времен Пастера прочно укоренился стереотип: микробы – это болезни, все микробы – враги; основное внимание уделялось патологическим состояниям, которые вызывает дисбаланс экосистемы. В XX веке появились антибиотики, способные справляться с отдельными инфекциями, что лишь усилило этот стереотип, ‒ и его всерьез не подвергали сомнению, пока бактериологи умели только сидеть у микроскопов и культивировать микробы в чашке Петри. Когда появились мощные компьютеры для обработки данных и новые технологии расшифровки ДНК, бактериологи научились смотреть на предмет гораздо шире: не все бактерии, видимые в микроскоп, можно культивировать, так как условия их роста неясны. А поскольку технологии молекулярного анализа не зависят от культурных стереотипов, бактериологи теперь могут разглядеть это «невидимое большинство».
Произошел важный скачок в истории науки: мы поняли, что в организме каждого из нас живет больше микробов, чем людей на Земле. Так возникли новые вопросы относительно многочисленных жизненно важных функций нашего микробиома.
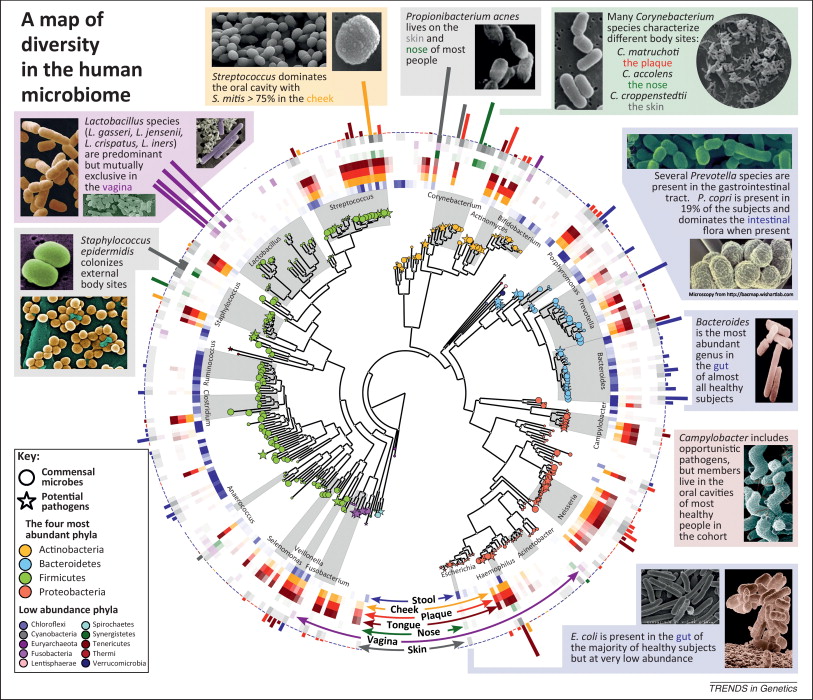
За последние годы мы многое узнали о нашей кишечной флоре. Больше всего микроорганизмов находится в толстом кишечнике. Ряд их функций хорошо изучен: это извлечение энергии из пищи, переваривание полисахаридов, синтез витамина K, а также комплекса витаминов группы B. Особо упомянем бактериальный синтез витамина B12, хотя этот витамин, получаемый с пищей, в основном всасывается в подвздошной кишке (это конечный отдел тонкого кишечника).
Микробы – защитники и воспитатели
О том, что «полезные» микробы могут быть защитой от вредных микробов, немногочисленные проницательные врачи поняли задолго до микробиомной революции. Уже в 1960-х годах во время эпидемий в палатах для новорожденных было обнаружено, что заселение организма младенца болезнетворными стафилококками можно предотвратить, если его в раннем возрасте принудительно заразить (через слизистые носа или пупочную ранку) специально подобранным штаммом стафилококка с минимальной вирулентностью1. О роли кишечной флоры как «воспитателя» иммунной системы заговорили относительно недавно. Микробиомная революция стоит на пороге глубокого переосмысления того, чтó представляет собой иммунная система. Эту систему можно сравнить с органом чувств, который без стимуляции правильно не развивается. Существуют даже работы, показывающие, что «обучение» иммунной системы начинается еще во время внутриутробной жизни, в частности, под воздействием материнской кишечной флоры2.
Микробы и психика
Исследования связи «кишечник-мозг» (gut-brain connection) находятся в числе самых многообещающих направлений научного поиска. До нынешнего времени мы опирались на данные экспериментов с животными. Судя по всему, существует критический период на ранних сроках жизни, когда микроорганизмы кишечника оказывают влияние на мозг и изменяют поведение в дальнейшей жизни. Так, самое примечательное исследование было проведено на специально выведенных породах мышей, лишенных бактерий, способствующих перевариванию пищи. В ходе опытов ученые одним мышам вводили такие бактерии, другим – нет. Обнаружилось, что у «стерильных» мышей в период зрелости гораздо чаще наблюдались гиперактивность и неадекватное поведение, склонность к риску. Если мышам давали эти нормальные бактерии в раннем возрасте, то у них складывались те же нормальные поведенческие черты, что у животных из контрольной группы. Если же нормальные бактерии они начинали получать в более позднем возрасте, то уже успевали сложиться черты гиперактивности и склонности к риску3. Результаты такого эксперимента дают аргументы в пользу существования так называемого кишечно-психического синдрома (GAPS) ‒ состояния, которое однозначно свидетельствует: между функциями пищеварительной системы и функциями мозга есть взаимосвязь.
Микробы – стражи у ворот
Несмотря на то, что до сих пор большинство исследований было посвящено колонизации пищеварительной системы (в том числе ротовой полости), мы не должны забывать, что триллионы бактерий, грибков, вирусов, архей и мельчайших членистоногих заселяют и поверхность кожи, в совокупности своей образуя кожный микробиом. Уже доказано, что заселение кожных покровов микробами оказывает решающее влияние на развитие иммунной функции кожи, и в этой области следует ожидать очень важных открытий4. Судя по всему, важность некоторых зон кожного микробиома недооценена. Лучшим примером довольно малоисследованной зоны с богатой бактериальной средой остается пупок5. Исследования микробиома молока и микробиома молочных желез также находятся лишь в зачаточной стадии.
Микробы и повседневная акушерская практика
Сегодня нам приходится искать объяснения резкому росту некоторых хронических заболеваний – еще и поэтому столь высок интерес к функциям микробиома. Анализ Базы данных первичного здоровья (www.primalhealthresearch.com) показывает, что эпидемиологи обнаруживают факторы риска таких заболеваний в перинатальном периоде. К ним относятся, например, ожирение, диабет II типа, аутизм, нервная анорексия, астма, аллергические заболевания, всевозможные аутоиммунные болезни, а также хронические воспалительные заболевания кишечника. Этот резкий взрыв заболеваемости породил ряд теорий и гипотез. Имеет смысл обратиться к тому, чтó происходит в критический период, когда стерильный плод резко переходит в мир микробов. В общем, сегодня есть новые основания для того, чтобы изучать роды с точки зрения бактериологии.
С самых первых шагов микробиологии и до 1970-х годов одной из задач акушерок и врачей, занимающихся родовспоможением, было защищать новорожденных от любых микробов, в том числе тех, что происходили из материнского организма. Когда начинались роды, женщину обычно брили, ставили ей клизму и обрабатывали антисептическими растворами область сосков. Все это вписывалось в рамки преобладавшей культурной модели, где микробы и болезнь были синонимами.
Новый этап в истории нашего понимания процесса родов с точки зрения бактериологии начался с появлением результатов исследований, показавших, что по сравнению с плацентой прочих млекопитающих человеческая плацента весьма эффективно переносит иммуноглобулин G (IgG) к плоду6. Уровень содержания этих антител в крови доношенного новорожденного ребенка почти равен материнскому, тогда как у детенышей крупного рогатого скота он может не достигать и 10% от материнского. Первоочередные потребности у человеческих младенцев и у детенышей других млекопитающих явно неодинаковы. Теленок, появившись на свет, непосредственно зависит от антител, которые он получит с первым молозивом. Иначе говоря, для многих видов млекопитающих, в частности коров, молозиво в прямом смысле слова жизненно необходимо. Для человека важнее всего то, какие микроорганизмы первыми заселят стерильный организм ребенка. Хорошо известная концепция, используемая бактериологами, дает нам основание придавать большое значение этому вопросу: идет «борьба за территорию», и победители, заселившие стерильное поле, скорее всего, будут там хозяйничать.
Сегодня стало ясно, что с точки зрения бактериологии новорожденному в идеале нужно незамедлительно оказаться в контакте лишь с одним человеком – своей матерью. Также ясно, что млекопитающему под названием «человек» предназначалось появляться на свет через богатую флорой зону промежности: своего рода гарантия того, что новорожденный, и в особенности его пищеварительный тракт и кожа, будут немедленно заселены разнообразными дружественными бактериями, носитель которых – его мать. Примечательно и то, что флора влагалища постоянно меняется на протяжении беременности, и ближе к родам в ней начинают преобладать дружественные лактобактерии Lactobacillus Johnsonii7,8. Материнский организм как будто готовится к тому, чтобы заселить новорожденного своей флорой.
Сегодня считается, что плацента проницаема для антител, и особенно интенсивно этот транспорт работает с 38-й недели9. Это правило справедливо, но требует оговорки: есть четыре подкласса IgG, среди них иммуноглобулины подкласса 2 переносятся плацентой не так эффективно, как прочие10,11. Быть может, с этим связана загадочная уязвимость младенцев (особенно недоношенных) к переносимым матерью стрептококкам группы B.
Заметим, что на протяжении тысячелетий во всех человеческих сообществах существовали верования и обычаи, из-за которых серьезным образом нарушался процесс колонизации организма новорожденного. Типичный пример – поверье, что первое молозиво вредно. Как правило, матерей и новорожденных разлучали, и начало грудного вскармливания откладывалось.
Кесарево сечение и антибиотики – безопасность обернулась опасностью
Сегодня, в эпоху медикализации деторождения, существуют новые мощные способы вмешиваться в процесс программирования иммунной системы. Большинство детей, появляясь на свет, попадает в незнакомую для них бактериальную среду. Легко убедиться в том, что дети, рожденные вагинально, и те, что родились кесаревым сечением, входят в мир микробов совершенно разными путями. Кроме того, обычная практика в перинатальный период – подвергать плод воздействию антибиотиков. Они используются в таких распространенных случаях, как стрептококк группы В у матери в анализах, преждевременный разрыв плодного пузыря, а также кесарево сечение. Некоторые общественные организации здравоохранения (например, NICE, National Institute for Clinical Excellence – Британский Национальный институт качества медицинской помощи) официально рекомендуют вводить антибиотик перед началом операции12.
(Влияние антибиотиков на состав кишечной флоры http://www.fxmedicine.com.au/sites/default/files/Human%20gut%20microbiota.pdf)
Бактериологический аспект деторождения становится злободневным сегодня, когда все больше данных свидетельствует: способ колонизации организма новорожденного сразу после рождения может иметь последствия как минимум в среднесрочной перспективе.
(Фильм Microbirth , http://microbirth.com/)
Среди подобных не слишком отдаленных последствий упомянем то, на что указывалось в выводах исследований, где сравнивалась иммунная активность клеток крови у младенцев, рожденных вагинально и кесаревым сечением13. Влияние способа рождения на иммунный ответ было различимо вплоть до 6-месячного возраста14. Упомянем также результаты исследований финских ученых, которые изучали фекальную флору 34 детей, родившихся вагинальным путем, и 30 детей, появившихся на свет кесаревым сечением на фоне профилактики антибиотиками. Анализы проводились в возрасте 3‒5 дней, 10, 30, 60 и 180 дней. Результат: у детей, рожденных кесаревым, колонизация фекальной флоры задерживалась. До 6-месячного возраста у них по-прежнему наблюдались отклонения в составе фекальной флоры15.
Итак, у нас есть доказательства среднесрочных последствий, значит, можно объяснять происхождение хронических болезней в контексте микробиомной революции, и это объяснение выглядит убедительно. Из результатов недавно проведенных исследований в разных областях медицины следует, что характер формирования кишечной флоры в перинатальный период имеет долгосрочные последствия и зависит от способа и места рождения. В работе голландских ученых показано, что сравнительно с больничными вагинальными родами домашние вагинальные роды показывают снижение риска экземы, пищевой аллергии и астмы. Когда ученые попытались определить, каким образом способ и место родов повлияли на развитие атопических состояний, обнаружилось, что медиатором была колонизация бактериями Clostridium difficile16. Настоящим прорывом стала статья, опубликованная в журнале Nature: авторы в своем исследовании смогли показать, что кишечная флора – весомый фактор в патофизиологии ожирения. Состав микрофлоры кишечника у людей с ожирением и с нормальным весом различен: у мышей и у людей ожирение зависит от изменения соотношения двух преобладающих разновидностей бактерий (тип Bacteroidetes и тип Firmicutes)17. Есть основания полагать, что такие изменения пропорций закладываются с рождения. Ряд недавно проведенных исследований показал, что роды кесаревым сечением – фактор риска ожирения, в особенности ожирения в трехлетнем возрасте18. По мере появления новых исследований кишечной флоры обнаруживаются новые причинно-следственные связи между ожирением и диабетом II типа, поскольку состав бактериальной флоры кишечника у диабетиков и недиабетиков различается19.
Вопросы, касающиеся колонизации пищеварительного тракта и колонизации ротовой полости, непосредственно связаны между собой. Journal of Dental Research опубликовал результаты основательного исследования, в котором показано, что способ, которым ребенок рождался на свет (вагинально или кесаревым сечением), влияет на состав микроорганизмов, живущих в ротовой полости у детей, и, как следствие, влияет на здоровье зубов в дальнейшем20.
С учетом сказанного основную проблему можно сформулировать так: в эру простой техники кесарева сечения, которая одновременно является эрой антибиотиков, иммунная система многих новорожденных не получает жизненно важной стимуляции в критический момент своего развития, и это повод для беспокойства21.
Изучение структуры микробиома молока в зависимости от того, как рождаются дети, находится на начальных этапах. С точки зрения бактериологии выводы из этих исследований таковы: значимые различия прослеживаются не между детьми, родившимися вагинально и кесаревым сечением, а между теми, что родились кесаревым до самопроизвольного начала родов и теми, кто появился кесаревым или вагинально после начала родов22. То, что различия коренятся в сроках операции, подтверждается исследованием кишечной флоры 4-месячных детей, проведенным канадскими учеными23. Вообще, недостаточно исследований, где сравнивались бы последствия кесарева сечения до родов и во время родов, ‒ и не только в области бактериологии.
Работы бактериологов, в которых показано, сколь принципиально отличие кесарева до родов и в родах, требуют осмысления с нескольких точек зрения, ибо тема эта очень сложна. Чтобы преодолеть эту сложность, для начала усомнимся в незыблемости давнего постулата о том, что внутриматочная среда стерильна. На самом деле считать, что рождение на свет – первая встреча с микробами, ‒ это, вероятно, упрощение. Недавние исследования показали, что у большинства детей первичный микробиом может формироваться до рождения24. Этот вывод, вероятно, будет подтвержден исследованиями плацентарного микробиома25.
Микробы и генетика
Последние достижения микробиологии – это, без преувеличения, революция. Учитывать микробиологический аспект сегодня приходится биологам всех специальностей, в том числе эволюционистам. Внезапно выяснилось, что микробиом – важный фактор эволюции животных и растений. Неологизм «хологенóм» помогает нам по-новому взглянуть на процесс эволюции: он подразумевает весь набор информации, которая может передаваться от поколения к поколению. Весь объем генетической информации – это клеточная ДНК, клеточные митохондрии и микробиом26.
Так или иначе, нам нужно быть готовыми к быстрой эволюции взаимоотношений между человеком и миром микроорганизмов. По своей важности в истории развития биологических наук микробиомная революция сравнима с открытием эпигенетики.
Возникновение и развитие эпигенетики вновь придало важности теории Ламарка и ее наследнице, дарвиновской теории; аналогично и микробиомная революция вернет из забвения работы Антуана Бешана, который догадался о существовании микробов и понял процесс брожения до Пастера. В то время, когда гремела слава Пастера, Бешан осмелился заявить: «Вместо того чтобы пытаться определить, какие аномальные условия приводят к болезни, давайте для начала поймем, какие нормальные условия делают нас здоровыми». Его понимание здоровья и болезни легко вписывается в контекст научного мышления XXI века27.
1 – Dubos R. Staphylococci and infection immunity. Am J Dis Child 1966; 105: 643-45.
2 – Samuli RautavaS, Maria Carmen ColladoMC, Seppo SalminenS, Erika IsolauriE. Probiotics Modulate Host-Microbe Interaction in the Placenta and Fetal Gut: A Randomized, Double-Blind, Placebo-Controlled Trial. Neonatology 2012;102:178-184 (DOI: 10.1159/000339182)
3 – Heijtz RD, WangS, Anuar F, et al. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A. 2011 Feb 15;108(7):3047-52. Epub 2011 Jan 31.
4 – Capone KA, Dowd SE, Stamatas GN, Nikolovski J. Diversity of the human skin microbiome early in life. J Invest Dermatol 2011 Oct;131(10):2026-32. doi: 10.1038/jid.2011.168. Epub 2011 Jun 23.
5 – Hulcr J, Latimer AM, et al. A Jungle in There: Bacteria in Belly Buttons are Highly Diverse, but Predictable. Plus One 2012;7(11):e47712. doi: 10.1371/journal.pone.0047712. Epub 2012 Nov 7.
6 – G Virella, M A Silveira Nunes, and G Tamagnini. Placental transfer of human IgG subclasses. Clin Exp Immunol. 1972 March; 10(3): 475–478
7 – Aagaard K, Riehle K, Ma J, et al. A metagenomic approach to characterization of the vaginal microbiome signature in pregnancy.PLoS One. 2012;7(6):e36466. doi: 10.1371/journal.pone.0036466. Epub 2012 Jun 13.
8 – Vaneechoutte M. The similarities between the vaginal microflora and the gut microflora.Presentation at the Mid-Pacific Conference on Birth and Primal Health Research.Honolulu October 26-28.
9 – Cederqvist LL, Ewool LC, Litwin SD. The effect of fetal age, birth weight, and sex on cord blood immunoglobulin values. Am J Obstet Gynecol. 1978 Jul 1;131(5):520-5
10 – Garty BZ, Ludomirsky A, Danon Y, et al. Placental transfer of immunoglobulin G subclasses. Clin Diagn Lab Immunol. 1994 Nov;1(6):667-9.
11 – Hashira S, Okitsu-Negishi S, Yoshino K. Placental transfer of IgG subclasses in a Japanese population.Pediatr Int. 2000 Aug;42(4):337-42.
12 – NICE’s updated guideline on caesarean section is available at www.nice.org.uk/guidance/CG132.
13 – Molloy EJ, O’Neill AJ, Grantham JJ, Sheridan-Pereira M, Fitzpatrick JM, Webb DW, Watson RW. Labor Promotes Neonatal Neutrophil Survival and Lipopolysaccharide Responsiveness. Pediatr Res 2004 May 5.
14 – Gronlund MM, Nuutila J, Pelto L, Lilius EM, Isolauri E, Salminen S, Kero P, Lehtonen OP. Mode of delivery directs the phagocyte functions of infants for the first 6 months of life. Clin Exp Immunol 1999; 116(3): 521-6.
15 – Gronlund MM, Lehtonen OP, Eerola E, Kero P. Fecal microflora in healthy infants born by different methods of delivery: permanent changes in intestinal flora after cesarean delivery. J Pediatr Gastroenterol Nutr 1999; 28(1): 19-25.
16 – van Nimwegen FA, Penders J, Stobberingh EE, et al. Mode and place of delivery, gastrointestinal microbiota, and their influence on asthma and atopy.J Allergy Clin Immunol. 2011 Nov;128(5):948-55.e1-3. Epub 2011 Aug 27.
17 – Turnbaugh PJ, Ley RE, Mahowald MA, et al.An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 21 December, 2005; 444:1027-1031.
18 – Huh SY, Rifas-Shiman SL, Zera CA, et al.Delivery by caesarean section and risk of obesity in preschool age children: a prospective cohort study. Arch Dis Child. 2012 Jul;97(7):610-6. Epub 2012 May 23.
19 – Larsen N, Vogensen FK, Van der Berg FWJ, et al. Gut microbiota in Human adults with type 2 diabetes differs from non-diabetic adults. PloS One February 5, 2010; 5(2): e9085.
20 – Lif Holgerson P, Harnevik L, Hernell O, et al. Mode of birth delivery affects oral microbiota in infants. J Dent Res. 2011 Oct;90(10):1183-8. Epub 2011 Aug 9.
21 – Bik E. Effect of mode of delivery on bacterial colonization of newborns. Presentation at the Mid-Pacific Conference on Birth and Primal Health Research.Honolulu October 26-28.
22 – Cabrera-Rubio R, Collado MC, Laitinen K, et al. The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. Аm J Clin Nutr.2012 Sep;96(3):544-51. doi: 10.3945/ajcn.112.037382. Epub 2012 Jul 25.
23 – Azad MB, Konya T, Maugham H, et al. Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months. CMAJ February 11, 2013 cmaj.
24 – Funkhouser LJ, Bordenstein SR. Mom knows best: the universality of maternal microbial transmission.PLoS Biol. 2013;11(8):e1001631. doi: 10.1371/journal.pbio.1001631. Epub 2013 Aug 20.
25 – Aagaard K, Ma J, Antony KM, Ganu R, Petrosino J, Versalovic J. The placenta harbors a unique microbiome.Sci Transl Med. 2014 May 21;6(237):237ra65. doi: 10.1126/scitranslmed.3008599.
26 – Brucker RM, Bordenstein SR.The capacious hologenome.Zoology (Jena). 2013 Oct;116(5):260-1. doi: 10.1016/j.zool.2013.08.003. Epub 2013 Aug 30.
27 – Antoine Béchamp. Les microzymas. Paris 1883. New edition 1990 by Centre International d’Etudes A. Béchamp.